Элементы
статистической термодинамики.
Энтропия и
неупорядоченность состояния системы.
Второй закон т/д имеет статистический характер. Он
утверждает существование некоего свойства системы S связанного с теплообменом и
T при которой этот теплообмен происходит.
Соотношение ![]() или для изолированной
системы
или для изолированной
системы ![]() были введены
Клаузиусом и являются математическим выражением закона №2 т/д. Свойства системы
S было названо энтропией, а второй закон т/д показывает, что приращение энтропии
или равно приведенной теплоте для равновесно – обратимых процессов или больше
ее для процессов неравновесных. То энтропия оказывается свойством системы,
связанным с одной стороны теплообменом, с другой необратимостью. Эта дуалистичность
помогает разобраться в S не с классических позиций Клаузиуса, а с точки зрения
развитой позже молекулярной статистики. Дуалистичность энтропии можно понять,
если использовать представления об атомно-молекулярном строении материи и
рассматривать состояния системы с точки зрения упорядоченности – неупорядоченности
движения или состояния, составляющих систему частиц. Примером упорядоченности
молекулярной структуры может служить правильно сформированный кристалл чистого
свойства при
были введены
Клаузиусом и являются математическим выражением закона №2 т/д. Свойства системы
S было названо энтропией, а второй закон т/д показывает, что приращение энтропии
или равно приведенной теплоте для равновесно – обратимых процессов или больше
ее для процессов неравновесных. То энтропия оказывается свойством системы,
связанным с одной стороны теплообменом, с другой необратимостью. Эта дуалистичность
помогает разобраться в S не с классических позиций Клаузиуса, а с точки зрения
развитой позже молекулярной статистики. Дуалистичность энтропии можно понять,
если использовать представления об атомно-молекулярном строении материи и
рассматривать состояния системы с точки зрения упорядоченности – неупорядоченности
движения или состояния, составляющих систему частиц. Примером упорядоченности
молекулярной структуры может служить правильно сформированный кристалл чистого
свойства при ![]() . В таком кристалле атом размещается в узлах кристаллической
решетки, около которых они совершают одинаковые колебательные движения с
нулевой энергией. Энтропия такого кристалла по Планку равна 0 (3-й закон т/д).
Идеальный порядок нарушается, если тело поглощает теплоту и нагревается.
. В таком кристалле атом размещается в узлах кристаллической
решетки, около которых они совершают одинаковые колебательные движения с
нулевой энергией. Энтропия такого кристалла по Планку равна 0 (3-й закон т/д).
Идеальный порядок нарушается, если тело поглощает теплоту и нагревается.
Нарушение упорядоченности связанное с нагревом ведет к
увеличению S
 , С-теплоемкость
, С-теплоемкость ![]()
Фазовые переходы, связанные с разрушением кристалла
(плавлением) сопровождаются изотермическими поглощением теплоты и резким
возрастанием S вещества.


DSисп>>DSпл ,т.е. при образовании наиболее
коотизированного состояния (пара или газа) возрастание S более интенсивно.
Процессы фазового перехода проведены в условиях
равновестности и дает значение 2-а закона т/д использованого для них со знаком
равенства. Но увеличение S системы возможно и без теплообмена при протекании
неравновесного процесса. Пример – замыкание аккумулятора на сопрот. в изолиров.
системе, когда электрическая энергия превращается в теплоту Джоуля без
совершения работы. При этом неупорядоченность молекулярного состояния системы
увеличивается, S возрастает =>S можно рассматривать как меру неупорядоченности
молекулярного состояния системы. Эти качественные представления количественно
развивает статистическая термодинамика. Она является частью более общего
раздела науки – статистической механики (конец 19 века основные положения
Больцман – Гиббс).
Микросостояния и ансамбли Гиббса.
Состояния системы в т/д определяемое ее свойствами –
P, V и T будем называть макросостояниями системы. От макросостояний следует
отличать микросостояния – которое характеризуется мгновенными значениями всех
зависящих от времени переменных N составляющих систему частиц. В общем случае
для описания положения в пространстве частицы (многоатомной молекулы) требуется
f обобщенных координат; q – обобщенная координата.
q1(t), q2(t)…..qf(t), t – время.
И столько же сопряженных с ними импульсов Pi(t),
i=1,2,3…f.
Многомерное пространство с 2f-координатами называется m-пространство – пространство молекулы. Точка в таком
фазовом пространстве будет представлять состоянием частицы в момент времени T.
А изменение этого состояния во времени изобразиться некоторой траекторией
движения. Для газа, содержащего N многоатомных молекул фазовое пространство
имеет уже 2Nf измерений и называется g-пространством (пространством газа). Точка в таком
пространстве изображает мгновенное состояние всей системы в целом, а траектория
определяется ур-ями вида
qi=q(t) u pi=p(t) , i=1,2,3…Nf которые определены
ур-ями движения Гамельтона.


Краткая запись этих ур-й H(q,p) – ур-е Гамильтона.
Если система находиться в равновесии, то ее макросостояние
не измен. во времени, но микрооненич. порционные могут меняться непрерывно, но
так, чтобы макросостояние оставалось неизменным. Поэтому с классической точки
зрения должно существовать бесчисленное множество микросост., совместимых с макроскопической
характеристикой т/д системы.
Для изучения статистического поведения т/д систем
Гиббс предложил метод ансамблей.
Ансамбль Гиббса – большой ряд микросостояний,
совместимых с данным макросостоянием. Ансамбль можно представить как очень
большое число ( в ![]() ) аналогичных т/д систем, но находящихся в различных стадиях
развития, т.е. в различных микросостояниях. По аналогии с понятием т/д
изолированных, закрытых и открытых систем, в зависимости от поставленной задачи
применяют различные ансамбли. В соответствии с ограничениями, налогаемыми на
т/д систему. Наиболее важным типом ансамблей являются микроканонический,
канонический и большой канонич. Микроканонический и канонический названы малыми
ансамблями. Микроканонический ансамбль соответствует изолированной системе,
которая не может обмениваться с окружением ни веществом ни энергией. Она характеризуется
каноническим ансамблем соотв. закрытой изотермической системе с постоянными значениеми
V,N,T. Такая система находиться в термическом равновесии с окружающей средой и
может обмениваться с ней энергией, но не вещ-вом. Он оказался наиболее удобным
для цепей статистической т/д. Большой канонический ансамбль соответствует открытой
изотермической системе,которая характеризуется
V, T, m. Он находиться как в тепловом так и в материальном равновесии со
средой, может обмениваться с ней в-вом и энергией.
) аналогичных т/д систем, но находящихся в различных стадиях
развития, т.е. в различных микросостояниях. По аналогии с понятием т/д
изолированных, закрытых и открытых систем, в зависимости от поставленной задачи
применяют различные ансамбли. В соответствии с ограничениями, налогаемыми на
т/д систему. Наиболее важным типом ансамблей являются микроканонический,
канонический и большой канонич. Микроканонический и канонический названы малыми
ансамблями. Микроканонический ансамбль соответствует изолированной системе,
которая не может обмениваться с окружением ни веществом ни энергией. Она характеризуется
каноническим ансамблем соотв. закрытой изотермической системе с постоянными значениеми
V,N,T. Такая система находиться в термическом равновесии с окружающей средой и
может обмениваться с ней энергией, но не вещ-вом. Он оказался наиболее удобным
для цепей статистической т/д. Большой канонический ансамбль соответствует открытой
изотермической системе,которая характеризуется
V, T, m. Он находиться как в тепловом так и в материальном равновесии со
средой, может обмениваться с ней в-вом и энергией.
Развитие во времени микроскопич динамического
состояния кажлого члена малого канонического ансамбля будет описываться
траекторией, изображающей точки в 2 Nf-мерном фазовом пространстве. Если же в
том же пр-ве находятся изображенные точки других членов ансамбля, то получается
как бы облако движущихся изображающих точек. Мгновенная плотность облака в
данной точке характеризуется нормированной ф-ей распределения
r(qi,oi)
,i=1,2,3,…,Nf
Величину следует понимать, как долю от общего числа
систем в ансамбле, приходящегося на единицу гиперобъема фазового пространства.
В области точки вероятность, что изображающая точка произвольно взятой системы
из ансамбля окажется в какой-то единице V фазового гиперпространства.
Подсчет
микросостояний по Больцману.
В системах, состоящих из большого числа одинаковых
молекул (1 моль газа) для описания механического состояния применяются фазовое m пространство 2f измерений, если f – число степеней
свободы молекулы. В таком пространстве каждая точка будет определять координаты
и импульсы данной молекулы. Число изменений в g – пространстве при описании состоянии всей системы в
целом будет в N раз больше, если N – число молекул в системе. Если между молекулами
системы практически отсутствует сила взаимодействия, то g – пространство системы можно представить совокупностью
m пространств.
В классической статике Больцмана макросостояния
системы например любого идеального газа характеризуются числом фигуротивных
точек в различных ячейках фазового пространства. Молекулы считаются различными
и обмен местами двух молекул находящихся в различных ячейках даст новое микросостояние
фаз изменение микросостояния. f .o. число микросостояний соотв. данному макро
можно подсчитать путем нахождения числа способов размещения фигуративных точек
по ячейкам. Пусть система состоит из N молекула, а ее макросостоянию соответствует
Ni точек в i – ячейке. Т.к. перестоновки внутри ячейки не считаются
т.к. они не дают новое микросостояние, то число микросостояний находится как
число перестановок с повторениями.
 , число G подсчитанное по этой формуле называется числом
комплексий.
, число G подсчитанное по этой формуле называется числом
комплексий.
Термодинамическая
вероятность и энтропия.
Основные положения т/д статистической механики даются
в виде постулатов.
Первый: постулат равной вероятности, второй – теорема
о средних значениях.
1 Постулат:
для изолированоой системы все достижимые области фазового пространства имеют
равные априорные вероятности (исходные). Иначе говоря для микроканонич ансамбля
изображающие точки распределены равномерно по достяжении фазового пространства.
2 Постулат:
ТЕОРЕМА: среднее по времени значения физически наблюдаемой величины F(q,p) для
системы равно среднему значению физически наблюдаемой величины по ансамблям.
Это следует из того,что каждая система ансамбля в
течении достаточно долгого времени будет приходить в состояние каждого другого
члена ансабля. Т.о. средних значениях позволяет установить точные связи между
т/д переменными и механическими макроскопическими характеристиками. Так, каждое
т/д свойство q под которым можно подразумевать p, энергию, S определяется как среднее
по времени некоторой динамической переменной q(q,p). Это можно выразить так:
![]() , причем
, причем 
Среднее по ансамблю выражается:
![]()
Тогда теорема о средних значениях записывается так, ![]() .
.
Это имеет смысл только для систем, состоящих из
достаточно большого числа достаточно взаимодействующих частиц, которые
называются эргоидными системами. Из постулатов равной вероятности следует,что
все микросостояния системы, совместимы с заданными условиями, например с постоянством
энергии математически равновероятные. Представление о микросостояниях, их
равной вероятности и о том что различным макросотояним может соответствовать
различное число микросостояний ведет к понятию т/д вероятности макросостояния
обозначаемой W
![]()
Т.о. т/д вероятность состояния пропорциональна числу
микросостояний, соответствующих данному макросостоянию. Коэффициент
пропорциональности можно положить равным 1 и рассматривать W как относительную вероятность по отношению к
вероятности стандартного состояния. Кроме того W можно рассматривать как
числитель математическую вероятность, в знаменателе которой стояло бы число
всех мыслимых для данной системы микросостояний, совместимых с законами
сохранения.
Т.о. W=G³1 Для обычных молекулярных систем в равновесном состоянии
W очень велико. Согласно Больцману статистический смысл 2-го закона тд состоит
в том, что изолированная система развивается в направлении большей т/д вероятности.
Т/д вероятность равновесного состояния для обычных молекулярных систем например
для 1-го моля газа, во много раз больше чем сумма т/д вероятностей всех
возможных неравновесных состояний:
![]()
Равновесное состояние соответствует наибольшему
состоянию W. Таким же образом меняется и энтропия изолированной системы,
поэтому ее можно считать функцией W.
S=f(W)
Для установления вида этой ф-ии рассмотрим 2-е независимых
системы свероятностями состояний W1 и W2. Т/д вероятность сложной системы, составленной
из этих двух выразиться произведениями:
![]()
Энтропия отдельных систем: S1=f(W1) u S2=f(W2)
А энтропия суммарной системы ![]() в силу аддетивности
данного экстенсивного св-ва системы.
в силу аддетивности
данного экстенсивного св-ва системы.
![]() , дифференцируем по W1 u W2:
, дифференцируем по W1 u W2: ![]()
![]() или
или ![]()


![]()
![]()
![]()
![]()
![]() При сравнении данного
выражения с определением d как функции W можно видеть, что const=0. Получаем уравнение Больцмана:
При сравнении данного
выражения с определением d как функции W можно видеть, что const=0. Получаем уравнение Больцмана:
S=k ln(W)
Впервые в таком виде это ур-е было получено Планком в
1900 г. Оно лежит в основе статистической т/д, k- произвольна, но ее желательно
выбрать так, чтобы энтропия, определяемая этим ур-ем, совпадала бы с обычной энтропией
2-го закона, связанного с теплопередачей.
С этой целью рассмотрим процесс изотермического
расширения идеального газа от V1 до V2.
 , где W1 и W2 – вероятнояти пребывания
1-ой молекулы с V1 и V2. Эти вероятности относятся также
как сами эти V, т.е. W2/W1=V2/V1. Если
молекулы 2-е, то
, где W1 и W2 – вероятнояти пребывания
1-ой молекулы с V1 и V2. Эти вероятности относятся также
как сами эти V, т.е. W2/W1=V2/V1. Если
молекулы 2-е, то  А для одного моля газа
NA молекул и
А для одного моля газа
NA молекул и  . Таким образом
. Таким образом ![]() для 1-го моля газа:
для 1-го моля газа:  , но для идеального газа имеет место:
, но для идеального газа имеет место: ![]() и
и  , k- Постоянная Больцмана.
, k- Постоянная Больцмана.
При статистическом толковании S системы, как меры
неупорядоченности ее состояния при поглощении теплоты следует рассмотреть
вопрос о Тепловой Смерти Вселенной.
Один из основоположников классической т/д Клаузис дал
следующюю формулировку 1-го и 2-го законов т/д:
Энергия мира постоянна (не вызывает сомнения в связи
отсутствия сведений об отклонении от закона сохранения энергии)
Sмира ® max
Относительно 2-го возникли разногласия: Клазиус,
распространяя на всю вселенную закон увеличения S для самопроизвольных
процессов в изолированной системе, приходит к неизбежному выводу о стремлении
мира к равновесию, когда выравниваются P, T, - тепловая смерть Вселенной.
Признаки неизбежного конца вселенной ведет к допущению
ее лагл, возникновению или акта творения. Это противоречит материалистической
ф-ии, подтверждая идеалистич. Поэтому до настоящего времени остается незавершенности
физического решения этой проблемы. Не вдаваясь в обсуждение характера завершения
представлений относит характера вселенной. Всетаки можно придти к выводу о
совершенно иных масштабах и физ. сущности космических явлений по сравнениюс
огромными земными наблюдениями, для которых и установлен 2-й закон т/д.
Закон
распределения молекул по энергиям. (З-н Больцмана).
Методы статистич т/д позволяют вычислить т/д ф-и
системы, состоящие из большого числа молекул на основе характеристик молекул,
полученных спектроскопическим, электрографическим, рентгено и другими методами.
Кроме того эти методы значит роль играют в хим
кинетике и в первую очередь в статистич. расчете скорости р-ции. (теория
абсолют скоростей)
В основе этих методов лежит закон распред. мол. по
энергиям
ВЫВОД: Для вывода з-на рассмотрим газообразную систему
которая состоит из очень большого числа N молекул. Сист обладает энергией U и занимает
постоянный объем V, т.е. находит в условиях U=const, V=const, такая система с
т/д точки зрения изолированна. Все молекулы ее химически идентичны, но могут
обладать различными энергиями. В простейшейм случае это будет энергий поступательного
движения ![]() , где m-масса, c-скорость движения частиц.
, где m-масса, c-скорость движения частиц.
Распределение молекул по энергиям дается указанием
чисел молекул, обладающих определенной энергией. N1 с энергией e1
N2 с энергией e2 и т.д.
Полная энергия рассматриваемой системы выразиться
суммой:
![]()
Постоянным будут также число молекул åNi=const . согласно квантовой механике одной и той же
энергии молекулы может отвечать несколько gi собственных состояний. В связи с
этим можно с почти одной и той же величиной ее. Такие кратные уровни называют
выражденными. А степень выраждения gi – статистическим весом уровня или его
суммарной вероятностью
Макросостояние системы однозначно определяется
распростронением неразличимых молекул по энергиям. Т/д вероятность состояния
запишем сначала число способов распределения N молекул по i-группам.

Внутри каждой группы Ni различаемых молекул могут
размещаться по gi уровням.
Одну молекулу можно разместить по gi уровням gi
способами. 2 молекулы – ![]() способами и т.д. => для Ni молекул число способов
размещения будет
способами и т.д. => для Ni молекул число способов
размещения будет ![]() . Полное число
макросостояний, т.е. т/д вероятность данного макросостояния W получиться
умножением найденного числа распределения по группам на числа распределения
внутри групп.
. Полное число
макросостояний, т.е. т/д вероятность данного макросостояния W получиться
умножением найденного числа распределения по группам на числа распределения
внутри групп.

Равновесному состоянию изотермической системы с т/д
точки зрения отвечает max энтропии. А со статистической – max т/д вероятности.
Связь между S u W дается формулой Больцмана:

ЧислаN u Ni
всегда слишком велики поэтому к факториалам можно применить формулу
Стирлинга, которая тем точнее, чем больше N.
 или в логарифмической форме
или в логарифмической форме ![]()
При больших N первый член в правой части равенства
можно отбросить.
![]()
Тогда  При равновесии значения S u W – max => дифференциалы:
При равновесии значения S u W – max => дифференциалы:
![]()
Частные изменения S будут:



 Тогда условием
равновесия будет равенство:
Тогда условием
равновесия будет равенство:  (*)
(*)
Используя 2-а ур-я связи:  можно выразить две из
величин dNi как ф-и всех остальных. Поэтому независимыми будут все изменения
Ni крому 2-х. Чтобы избавиться от зависимости изменений используем метод неопределенных
методов Лагранжа. Для этого умножим dN u dU соотв. на l и m и суммируем с (*)
можно выразить две из
величин dNi как ф-и всех остальных. Поэтому независимыми будут все изменения
Ni крому 2-х. Чтобы избавиться от зависимости изменений используем метод неопределенных
методов Лагранжа. Для этого умножим dN u dU соотв. на l и m и суммируем с (*)
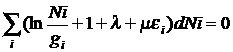 Производные множ. l и m подбирают так, чтобы 2 из коэффициента при dNi равнялось 0
Производные множ. l и m подбирают так, чтобы 2 из коэффициента при dNi равнялось 0
Пусть  и
и 
Тогда в сумме останутся лишь слагаемые, содержащие
независимые вариации чисел dNi. В этом случае общее равенство будет равно 0,
если каждый из (i-2) коэф. тоже равен 0. Т.о для изолированной равновесной системы,
состоящей из N слабовзаимодействующих молекул справедливо равенство. 

Уравнение Больцмана.
Полученное выражение – общий вид закона распределения
молекул по энергиям в классической статистике Максвелла-Больцмана. Для
получения конкретного вида распределения необходимо найти В и m.
Для этого сложим все числа молекул.
 , откуда
, откуда 
 ;
; ![]()
![]()
![]() , с учетом U и N:
, с учетом U и N:
 или
или
![]() дифференцируем по S
при V=const последний член не зависит от S
дифференцируем по S
при V=const последний член не зависит от S
 ,
, 
![]() Тогда уравнение
Максвелла-Больцмана можно представить:
Тогда уравнение
Максвелла-Больцмана можно представить:  Эта формула – выражение закона распределения Больцмана, которое
читается так:
Эта формула – выражение закона распределения Больцмана, которое
читается так:
Для молекулярной системы, находящейся в равновесии,
число молекул, обладающих энергией ei пропорционально
множителя Больцмана »ee/kT.
Определение молекулярной суммы
по состояниям.
С учетом выражения ![]() закон Больцмана запишем в виде:
закон Больцмана запишем в виде:
 или
или

 – молекулярная сумма
по состояниям – сумма множителей Больцмана, записанных для всех возможных
энергетических состояний молекул. Если назвать состояние молекулы с наиболее
низкой энергией нулевым, то сумма по состояниям отдельной молекулы в
развернутом виде записывается так:
– молекулярная сумма
по состояниям – сумма множителей Больцмана, записанных для всех возможных
энергетических состояний молекул. Если назвать состояние молекулы с наиболее
низкой энергией нулевым, то сумма по состояниям отдельной молекулы в
развернутом виде записывается так:
 ,
,
где суммируются все возможные энергетические состояния
молекулы. При записи закона Больцмана сумму по состояниям можно рассматривать
как обобщенный множитель Больцмана, характеризующий полное число молекул
данного вида в системе.
 .
.
Сумма по состояниям не имеет размерности и помогает
описать в удобной математической форме распределение энергии между молекулами в
системе.