Лекция
№20
ГАЛОГЕНПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ.
План.
- Классификация
и номенклатура.
- Методы
получения.
- Физические
свойства и строение.
- Химические
свойства.
Галогенпроизводные
углеводородов можно рассматривать как результат замещения однако или более
атомов водорода в углеводороде на атомы галогенов. В зависимости от характера
связи С-Hal различают следующие типы галогенуглеводородов:
1. Галогенпроизводные со связью С(sp3)-Hal
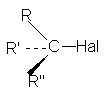
где R, R/, R// - атом водорода или алкильной радикал.
2. Галогенпроизводные со связью С(sp2)-Hal

3. Галогенпроизводные со связью С(sp)-Hal
R-Cº C-Hal
Галогенпроизводные типа С(sp3)-Hal
Классификация и номенклатура
К галогенпроизводным углеводородов со связью С(sp3)-Hal относятся:
а) галогеналканы СnH2n+1 Hal, СnH2n+2–x Halx,
где х=0 ....... 2n+2
б) галогенциклоалканы СnH2n-1 Hal, СnH2n–х Halх,
где х=0 ...... 2n
в) галогеналкены с атомом галогена в алкильном заместителе при двойной связи
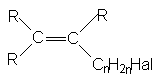
г) галогеналкины с атомом галогена в алкильном заместителе при тройной связи
R-Cº C-СnH2n- Hal
д) галогенарены с атомом галогена в боковой алкильной цепи
ArCnH2n – Hal, ArCnH2n+1–xHalх,
где х=0 ...... 2n+1
В основе названия галогенуглеводорода по номенклатуре IUPAC лежит название самой длинной неразветвленной цепи. Атомы углерода нумеруют таким образом, чтобы меньший номер получил заместитель, который в названии пишется первым, а сами заместители перечисляются в алфавитном порядке. Цепи углеродных атомов в галогенпроизводных алкенов и алкинов нумеруют с того конца, к которому ближе расположена кратная связь
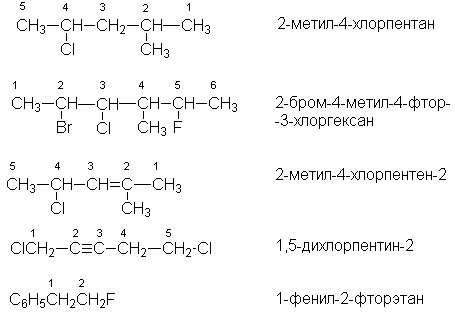
Для некоторых простейших галогенпроизводных углеводородов сохраняются названия, в основе которых лежит название углеводородного остатка
СH3Cl – метилхлорид,
СH3J – метилиодид,
С2Н5Вr – этилбромид,
С6H5CHCl2 – бензилиденхлорид
СH2Cl2 – метиленхлорид,
С6H5CH2Cl – бензилхлорид,
Для некоторых галогенпроизводных сохраняются тривиальные названия:
СHCl3 – хлороформ,
СHBr3 –бромоформ,
CHJ3 – иодоформ
Для названия полностью галогенированных углеводородов используется префикс пер–:
С2F6 – перфторэтан
C3Cl8 – перхлорпропан
Для соединения СCl4 применяется название тетрахлорид углерода и четыреххлористый углерод.
Методы получения
1. Заместительное галогенирование.
Объектом заместительного галогенирования могут быть алканы. В общем виде реакции заместительного галогенирования алканов выражаются уравнением:
RH + Hal2 ® RHal + HНal
Таким способом можно получить фтор-, бром- и хлоралканы. Подробно об особенностях этих реакций – см. Химические свойства алканов.
Аллильное хлорирование алканов можно осуществить при высоких температурах (400-500оС) в паровой фазе
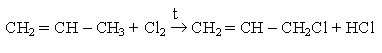
Для аллильного бромирования алканов в качестве реагента используют бромсукцинимид
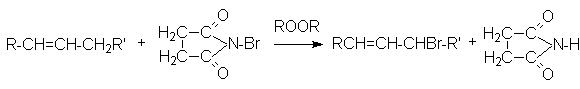
Хлорирование и бромирование боковых цепей алкиларенов можно осуществлять в условиях инициирования свободнорадикальных реакций (химические инициаторы, фотоинициирование), причем наиболее реакционноспособным оказывается a -положения боковой цепи:
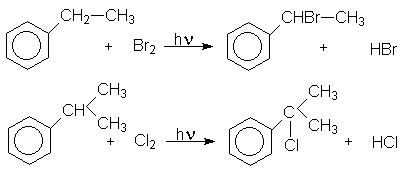
2. Присоединительное галогенирование алкенов и алкинов.
Возможности этого метода можно проиллюстрировать следующими реакциями:
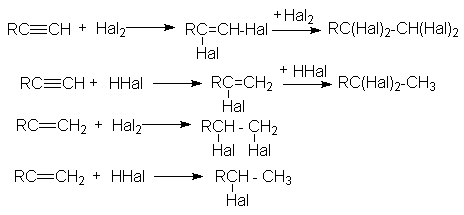
Особенности приведенных реакций подробно обсуждались в разделах, посвященных химическим свойствам алкенов и алкинов. Здесь лишь отметим, что при реализации этих реакций в промышленности с целью форсирования процессов используют катализаторы типа кислот Льюиса (FeCl3, SnCl4, SbCl3 и др.)
3. Реакции замещения гидроксильных групп на галоген в спиртах.
К таким реакциям относятся:
а) взаимодействие галогеноводородов со спиртами
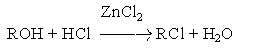
Важным фактором эффективности этих реакций является высокая кислотность среды, обеспечивающая стабилизацию уходящей гидроксильной группы:
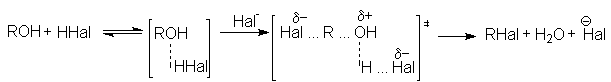
Каталитическое действие хлорида цинка связано с образованием более сильной протонной кислоты за счет донорно-акцепторного взаимодействия:
![]()
которая в последующем выполняет каталитическую функцию. В связи с важностью поддержания кислотности среды в этих реакциях в качестве гидрогалогенирующих реагентов можно использовать комбинации соль-кислота, например, KBr + H2SO4.
Иногда в качестве реагентов используют смеси, продуцирующие in situ необходимый галогеноводород:
2P + 3J2 + 6H2O ® 6HJ + 2H3PO3
б) Взаимодействие галогенангидридов кислот (PСl3, PВr3, PСl5, SOCl2, PJ3 и др.) со спиртами:
PCl3 + 3ROH ® 3RCl + H3PO3
PCl5 + 5ROH ® 5RCl + H3PO4 + H2O
SOCl2
+ ROH ® RCl + SO2
+ HCl
SF4
+ 2KOH ® 2RF + SO2
+ 2HF
в) Взаимодействие галогенангидридов кислот (PСl5, PBr5, SF4) c альдегидами и кетонами
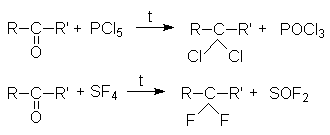
где R’=H, R, Ar.
4. Замещение галогена на галоген.
Замещение более легкого галогена в галогенуглеводороде более тяжелым
RCl + KBr ® RВr + KCl
обеспечивается проведением реакции при умеренных температурах и избытке галогенирующего реагента в неполярных апротонных растворителях.
Замещение более тяжелого галогена более легким
RJ + KCl ® RCl + KJ
обеспечивается проведением реакции при повышенных температурах и избытке галогенирующего реагента в высокополярной среде в присутствии катализатров - кислот Люиса, например, Сu+, Ag+ и пр.
5. Галогенметилирование аренов
Физические свойства и строение
Галогенпроизводные углеводородов являются бесцветными газами или жидкостями со своеобразным сладковатым запахом. В воде нерастворимы и в большинстве случаев тяжелее ее. Некоторые полигалогенпроизводные образуют бесцветные кристаллы, полииодсоединения имеют желтую окраску.
Температура кипения возрастает при увеличении атомной массы галогена и числа атомов галогена и углерода. Исключением являются полифторалканы, температура кипения которых уменьшается при увеличении числа атомов фтора в молекуле полифторалкана. При переходе от фторпроизводных к подпроизводным увеличивается их поляризуемость, что соответствует ряду поляризуемости атомов:
J > Br > Cl > F
Энергия связи С-Hal меняется в ряду
D(C – F)
> D(C – Cl) > D(C – Br) > D(C – J)
Моногалогенпроизводные имеют значительные дипольные моменты, что свидетельствует о полярности связи С-Hal. Это связано с более высокой электроотрицательностью атомов галогенов по сравнению с углеродными атомами:
![]()
Неподеленные пары электронов на атомах галогенов придают молекуле галогенуглеводородов слабые электронодонорные свойства, которые увеличиваются в ряду
RJ > RBr > RCl > RF
Химические свойства
Химическое поведение галогенуглеводородов определяется такими факторами как энергия связи С–Hal, полярность этой связи и ее поляризуемость. Так, относительная слабость связей С–Cl, C–Br и СJ обусловливает их предпочтительное гомолитическое расщепление по сравнению со связями С–С и С–Н. В то же время полярность связей С–Hal и их более высокая поляризуемость по сравнению со связями С–С и С–Н является предпосылкой для их гетеролитического расщепления. Приводимые ниже реакции являются иллюстрацией этих положений.
1. Замещение галогена на водород.
Восстановление галогенпроизводных до углеводородов осуществляется водородом в присутствии обычных катализаторов гидрирования (Ni, Pt, Pd):
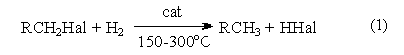
Реакция имеет гомолитический характер, связанный с предварительной сорбцией реагентов на поверхности катализатора, причем водород претерпевает диссоциативную адсорбцию с вовлечением адсорбированных атомов водорода в реакцию восстановления
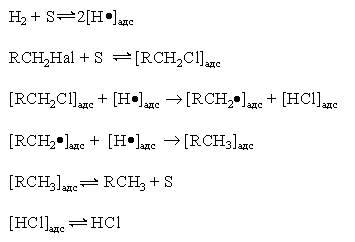
где S – поверхность катализатора.
Реакция (1) имеет важное практическое значение как метод переработки галогенорганических отходов в промышленном органическом синтезе. В отличие от другого метода обезвреживания галогенорганических отходов, сжигания, этот метод является ресурсосберегающим и экологически безопасным, так как при его реализации регенерируется углеводородная составляющая исходного сырья и исключается образование высокотоксичных полихлордибензодиоксинов и полихлордибензофуранов.
Другой метод замещения галогена на водород – взаимодействие галогенпроизводных углеводородов с иодоводородной кислотой при нагревании
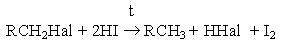
Метод имеет препаративное значение.
2. Взаимодействие с металлами.
а) реакция димеризации (синтез Вюрца)
2RHal + Na ® R–R + 2NaHal
Механизм этой реакции может быть представлен следующей последовательностью стадий:
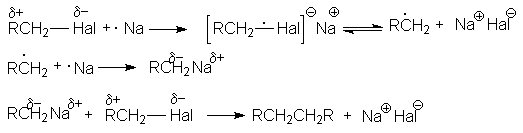
Такой характер взаимодействия является выражением природы реагентов. Натрий как очень активный металл легко отдает свой электрон молекуле галогенуглеводорода, которая выступает в роли слабого электрофила. Электрофильные свойства молекулы R–Hal вытекают из полярности связи С–Hal, обусловливающей дефицит электронов на атоме углерода. Образующийся интермедиат распадается на алкильный радикал и натриевую соль галогена, причем прочная ионная связь в последней обусловливает легкость этого распада. Аналогично можно объяснить энергетическую выгодность последующих реакций механизма.
Реакция имеет препаративное значение.
б) Взаимодействие с магнием (реакция Гриньяра).
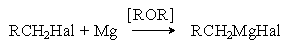
Механизм этой реакции в части ее инициирования подобен механизму реакции Вюрца
![]()
Реактивы Гриньяра имеют важнейшее значение в препаративной органической химии, поскольку открывают возможности получения широкого разнообразия органических соединений на основе взаимодействия этих реактивов с различными реагентами.
3. Реакции нуклеофильного замещения
Реакции нуклеофильного замещения – наиболее типичный круг реакций, в которых галогенуглеводороды выступают в качестве субстратов. Результатом этих реакций является замещение галогена на другой атом или группу, которые либо непосредственно выступают в роли нуклеофильного реагента, либо входят в его состав в качестве фрагмента.
Наиболее типичными реакциями нуклеофильного замещения галогеналканов и других галогенпроизводных являются:
а) реакции гидролиза
RHal + H2O ® ROH + HHal
RHal + NaOH ® ROH + NaHal
б) реакции образования простых эфиров (реакция Вильямсона)
RHal + R`ONa ® ROR` + NaHal
в) синтез сложных эфиров
R1Hal
+ RCOONa ® RCOOR1
+ NaHal
г) аммонолиз
RHal + 2NH3 ® RNH2 + NH4Hal
д) синтез нитросоединений и нитритов

е) синтез нитрилов и изонитрилов
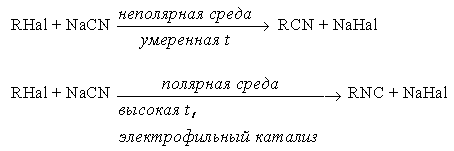
ж) синтез тиолов и сульфидов
R–Hal + NaSH ® RSH + NaHal
R–Hal + R1SNa
® RSR1 +
NaHal
2R–Hal +
Na2S ® RSR + 2NaHal
з) синтез фосфорорганических соединений
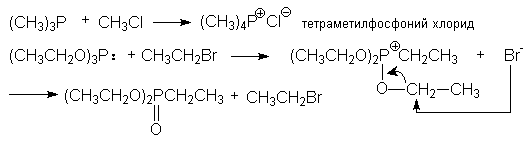
(CH3)2PH
+ CH3CH2Br + NaOH ® (CH3)2PCH2CH3
+ NaBr + H2O
диметилэтилфосфин
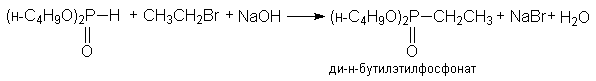
и) синтез углеводородов на основе Mg-органических соединений
R–MgHal +
R’Hal ® R–R’ + MgHal2
к) замещение галогена на галоген
RX + NaY ® RY + NaY
(см. подробно методы получения галогеналканов)
Из приведенных реакций можно видеть, что реакции нуклеофильного замещения могут служить методом образования связей С–С, С–О, С–S, C–N, C–P и C–Hal.