Лекция №25
МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
План
Методы получения литийорганичеких соединений.
1. Взаимодействие металлического лития с органическими галогенидами в гексане (до 40оС) или ТГФ (–30оС):
![]()
2. Взаимодействие металлического лития с ртутьорганическими соединениями в эфире, ТГФ или гексане:
![]()
3. Взаимодействие алкиллития с органическим галогенидом или углеводородом.
![]()
Недостатки литийорганического синтеза: низкие температуры, высокая пирофорность, большое потребление инертных газов, очень высокая активность получаемых реагентов, низкая плотность лития, основные группы органических соединений нельзя получить, используя литийорганические соединения.
В отличие от литийорганического синтеза, магнийорганический синтез проще, менее пожароопасен и не требует использования высокоскоростных мешалок.
Методы получения магнийорганических соединений
1. Взаимодействие металлического магния с органическими галогенидами в различных растворителях:
![]()
В лабораторной практике используется диэтиловый эфир (выход 50-100%), в промышленности – ТГФ, смеси ТГФ с углеводородами (толуол, ксилол), диметиловый эфир этиленгликоля, диэтиловый эфир диэтиленгликоля.
Образование реактивов Гриньяра осложняется побочной реакцией:
![]()
Чтобы ее избежать в промышленности применяют реакторы проточного типа. Преимуществами реакторов проточного типа являются 100%-я конверсия по галогенуглеводороду, высокая пожаробезопасность и высокая производительность. В лабораторной практике и фармацевтической промышленности используются стационарные реакторы.
2. Взаимодействие металлического магния с другими металлорганическими соединениями:
![]()
где Ме = Hg, Li.
3. Взаимодействие реактива Гриньяра с углеводородом:
![]()
где R1 = метил, трет-бутил.
4. Взаимодействие литийорганических соединений с галогенидами магния:
![]()
Механизм образования реагентов Гриньяра
В настоящее время не существует единого взгляда на общий механизм реакции. Хотя существует около 30-ти механизмов, наиболее принятым считается механизм Блонберга, Бодевидца и Бикельхаунта (для органических хлоридов).

Механизм образования литийорганических соединений

За протекание реакции
![]()
отвечают кислотные свойства С-Н протонов в углеводородах.
Депротонирование наиболее часто используется для получения резонансно- и индуктивно-стабилизированных карбанионов. В этом случае под карбанионом понимают магниевые и литиевые соли карбанионов. В настоящее время предложено шкал термодинамической кислотности. Наиболее часто используется шкала Крама, МСЭТ, шкала Бордвела.
Таблица 25.1.
Кислотность по Бордвелу некоторых С-Н кислот в диметилсульфоксиде.
|
С-Н
кислоты |
pKa |
|
PhCH(CN)2 |
4,2 |
|
PhCOOH |
11,0 |
|
CH2(CN)2 |
11,1 |
|
CH3NO2 |
17,2 |
|
PhOH |
18,2 |
|
Ph-C(O)-CH3 |
24,7 |
|
Ph-CºCH |
28,7 |
|
CH3OH |
29,0 |
|
Ph3CH |
30,6 |
|
H2O |
31,4 |
|
Ph2CH2 |
32,1 |
|
H2 |
36,0 |
|
CH4 |
55,0 |
Ароматичность играет очень важную роль в стабилизации анионов, что проиллюстрировано в таблице 25.1.
Из таблицы 25.1 может быть получен ряд способностей различных групп стабилизировать заряд на соседнем атоме углерода:
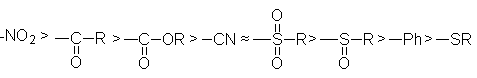
Наиболее сильное стабилизирующее действие проявляется главным образом благодаря резонансу. В этом ряду так действуют все группы кроме -SR, которая стабилизирует с помощью поляризации. Почти любой тип неметаллического атома, связанного с атомом углерода будет делать протон достаточно кислым, чтобы он мог быть оторван сильным основанием (бутиллитий).
Действие других стабилизирующих групп основано на стабилизации карбанионов, возникающих после отрыва протона водорода и зависит от характера карбанионного центра.
Sp > Sp2 >
Sp3
–Ph > –CH=CH2 >
–CH3 > –C2H5 > –CH(CH3)2
> –C(CH3)3
Строение реагентов Гриньяра и литийорганических соединений
В простых литий- и магнийорганических соединениях атом углерода, имеющий заряд, чаще всего находится в состоянии Sp3. В кристаллическом состоянии металлорганическая связь может соединять атом углерода с одним, двумя или с тремя атомами металла.

Кристаллические мономеры С2H5MgBr·2C2H5–O–C2H5.

где S – растворитель.
К димерным относятся (СН3)3Al, C2H5MgBr·(C2H5)3N

Тетрамеры – СН3Li и C2H5Li.
Гексамеры – C2H5Li в газовой фазе.
Полимерные структуры имеют (СН3)2Mg, (C2H5)2Mg, CH3K и др.
В растворах простых эфиров металлорганические соединения представляют собой набор частиц, строение которых описывается равновесием Шленка.

В сильнополярных растворителях (ГМФТА) реагенты Гриньяра находятся в равновесии в виде сольватно разделенных пар или карбанионов:
![]()
В случае стабильных карбанионов (бензил, 3-фенилметил) равновесие практически полностью смещено в сторону сольватно разделенных пар и карбанионов, поэтому растворы PhCH2MgHal в ГМФТА имеют красный цвет.
Получение производных меди
Литий- и магнийорганические соединения являются очень активными и часто промежуточные продукты реакции (кетоны) нельзя выделить из реакционных смесей или невозможно получить с высокими выходами продукты сочетания типа R-R. Поэтому в синтетической практике получили распространение медьорганические соединения типа R2Cu. Простые медьорганические соединения как правило неустойчивы и разлагаются при нагревании до R–R.
![]()
Поэтому подобные соединения применяются только для получения продуктов сочетания и могут быть получены:
![]()
Но если вместо RMgX взять RLi, то:
![]()
Основное применение диалкилкупратов лития - образование продуктов сочетания с различными иод- и бромзамещенными. В этом случае не затрагиваются двойные связи.

Диалкил- и диариллитийкупраты можно использовать для получения кетонов, альдегидов и углеводородов, которые не могут быть получены литий- и магнийорганическим синтезом.