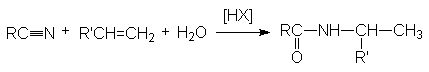Кето-енольная таутомерия эфиров 1,3-кетокислот
и реакции таутомерных форм.
Эфиры
1,3-кетокислот по своему химическому поведению близки к 1,3-дикетонам. Однако
их кислотность ниже. Для них характерна кетоенольная таутомерия.
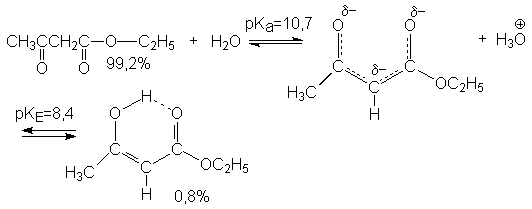
Как и в случае 1,3-дикетонов таутомерное равновесие чувствительно к сольватирующей способности реакционной среды. Так, в растворе метанола образуется 8,7% енола.
Анионы эфиров 1,3-кетокислот представляют собой сопряженную систему с выровненными связями и делокализованным отрицательным зарядом. Они содержат несколько реакционных центров. Их соли в растворах существуют в виде ионных пар. С ионами тяжелых металлов они образуют внутренние комплексы (хелаты). Соли 1,3-кетокислот подобны солям 1,3-дикетонов. Они легко алкилируются и ацилируются
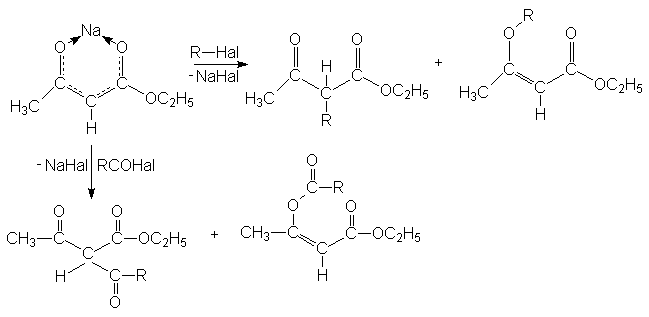
Алкилирование и ацилирование происходит главным образом у углеродного атома, т.к. атомы кислорода в значительной степени блокированы ионом металла.
Если в полученных продуктах алкилирования или ацилирования при атоме углерода в положении 2 содержится еще один кислый атом водорода открывается дополнительная возможность введения в это положение алкильных или ацильных групп, например
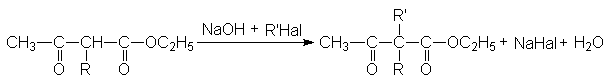
Последующий гидролиз и нагревание приводит к синтезу 1,3-кетокарбоновой кислоты и соответствующего кетона
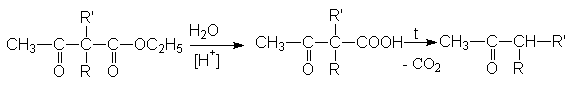
Эти реакции представляют собой важных синтетический метод получения кетонов различных структур.
Ацилоиновая конденсация
В отличие от конденсации Кляйзена в ацилоиновой конденсации ключевую роль играют сложноэфирные группы. Суммарно ацилоиновая конденсация может быть представлена схемой:
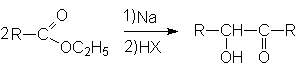
Механизм ацилоиновой конденсации может быть представлен последовательностью стадий:
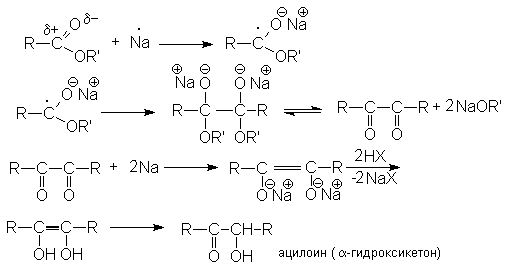
Реакция представляет собой важнейший метод образования углерод-углеродной связи. Она имеет большое значение для синтеза соединений с большими циклами.
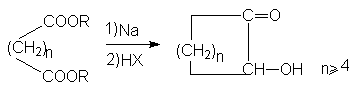
АМИДЫ КАРБОНОВЫХ КИСЛОТ
Эти соединения следует рассматривать как результат замещения гидрокси-группы в карбоновой кислоте на амино-группу
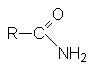
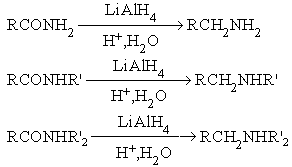
Методы получения амидов:
- Ацилирование
аммиака и аминов.
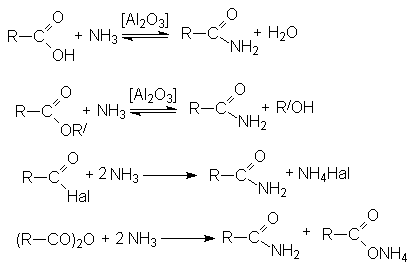
- Дегидратация
аммониевых солей карбоновых кислот
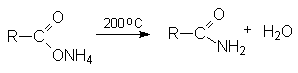
- Гидролиз
нитрилов карбоновых кислот
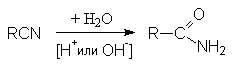
- Перегруппировка
оксимов кетонов по Бекману
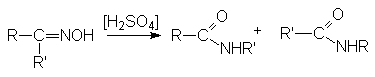
Обычно к атому азота мигрирует та группа, которая находится в транс-положении к ОН-группе.
Механизм перегруппировки Бекмана:
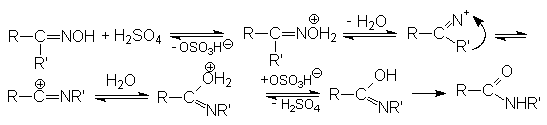
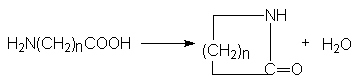
Синтез лактамов - циклических амидов.
- Перегруппировка
циклических амидов – лактамов
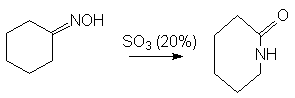
- Реакция Байера-Виллигера
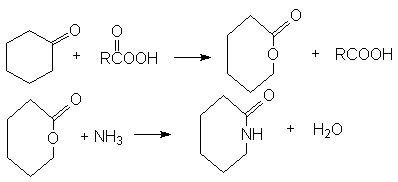
- Циклизация аминокислот
(n³ 3)
Физические свойства амидов. Строение амидной группы.
Амиды представляют собой бесцветные кристаллические вещества или жидкости, растворяющиеся в органических растворителях. Амиды, в молекулах которых имеются связи N-H, ассоциированы вследствие образования межмолекулярных водородных связей и имеют более высокие температуры кипения.
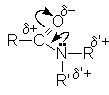
В молекулах амидов имеет место значительное сопряжение неподеленной парой электронов азота и p -электронной системой двойной связи С=О. Это приводит к образованию дополнительной поляризации связей в амидной группе и наличие электрофильных реакционных центров на ацильном и алкильных углеродных атомах и отрицательного - на карбонильном кислороде.
Химические свойства амидов.
- Реакции
нуклеофильного замещения.
Примером
может служить гидролиз. В нейтральной среде гидролиз протекает медленно. Поэтому
реакцию ведут в присутствии минеральной кислоты либо основания, которые не
только ускоряют ее, но и участвуют как реагенты.
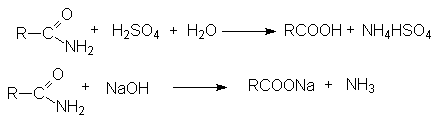
Активация молекулы амида кислотой связана с ее протонированием и увеличением положительного заряда на карбонильном углероде, который становится более восприимчивым к последующей нуклеофильной атаке:
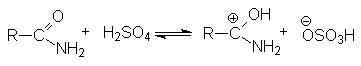
В случае щелочного гидролиза в качестве нуклеофила вместо воды выступает более реакционно способный гидроксил-анион, который эффективно осуществляет нуклеофильную атаку на кaрбонильный углерод:
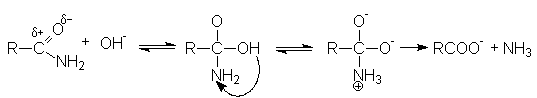
- Реакция
восстановления.
- Реакция
дегидратации.
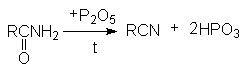
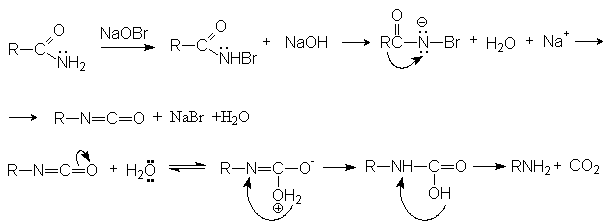
- Расщепление
по Гофману.
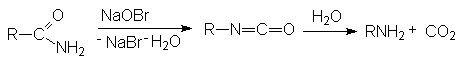
Механизм реакции
- Перегруппировка
Курциуса характерна для азидов карбоновых кислот, которые ведут себя
подобно амидам в расщеплении по Гофману.
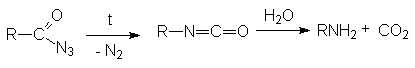
- Взаимодействие
формамидов с реактивом Гриньяра (реакция Буво)
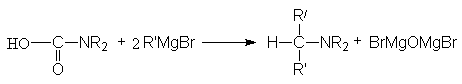
Продуктами этой
реакции являются альдeгид и третичный амин.
НИТРИЛЫ КАРБОНОВЫХ КИСЛОТ
Общая формула нитрилов R-Cº N или CnH2n+1CN.
Методы получения нитрилов.
- Дегидратация
амидов карбоновых кислот с помощью водоотнимающих агентов.
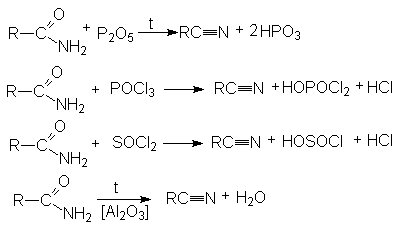
На практике в последнем
случае пропускают над катализатором смесь карбоновой кислоты с аммиаком. В этом
процессе совмещается образование амида и его дегидратация.
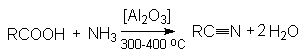
- Нуклеофильное
замещение галогена в галогеналканах на циaнид-анион.
![]()
- Дегидратация
альдоксимов.
![]()
Механизм реакции:
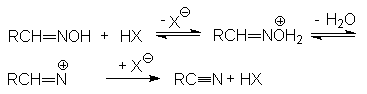
Химические свойства нитрилов.
Циано-группа характеризуется высокой степенью поляризации, следствием которой является образование частичного положительного заряда на углероде и отрицательного заряда – на азоте
![]()
Это обусловливает, с одной стороны, восприимчивость углеродного центра к нуклеофильной атаке, с другой – основность атома азота.
- Реакции
нуклеофильного присоединения.
Нитрилы
легко реагируют с сильными анионными нуклеофильными реагентами (карбанионами,
амидами металлов, щелочами, алкоголятами, тиоалкоголятами)
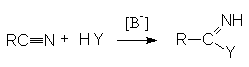
Примером может служить щелочной гидролиз нитрилов:
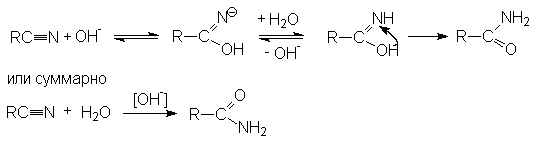
Дальнейший
гидролиз амида приводит к образованию солей карбоновых кислот.
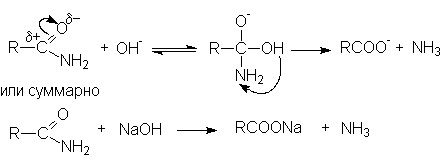
Таким образом суммарное уравнение щелочного гидролиза нитрилов можно представить как
R-Cº N + H2O + NaOH ® RCOONa + NH3
Реакции нитрилов со слабыми нуклеофилами (водой, спиртами) протекает крайне медленно. Для эффективного проведения этих реакций используют кислотный катализ. Активация молекулы нитрила в этом случае осуществляется за счет образования водородной связи между кислотой – катализатором и атомом азота и, как следствие, увеличение положительного заряда на нитрильном углеродном атоме.
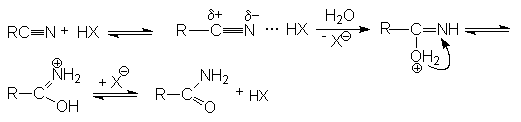
На последующей стадии гидролиза кислота НХ выступает одновременно как ускоритель реакции и реагент.
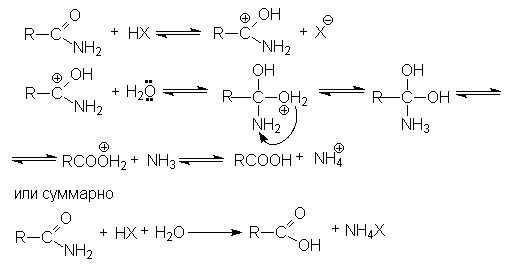
Таким образом, полный кислотный гидролиз нитрилов описывается уравнением:
R-Cº N + 2H2O + HX ® RCOOH + NH4X
Если в качестве реагента использовать водно-спиртовые среды, то можно осуществлять синтез сложных эфиров
R-Cº N + R'OH + H2O + HX ® RCOOR' + NH4X
- Гидрирование.
Реакции
гидрирования нитрилов можно подразделить на две группы:
а) каталитическое гидрирование
![]()
В качестве катализаторов этих реакций используют металлические Pt, Pd, Ni.
б) реагентное гидрирование
![]()
В качестве реагентов этих реакциях используют LiAlH4, NaBH4.
Механизм реакции:
RCº N + LiAlH4 ® RCH=N-Li + AlH3
RCH=N-Li + HX ® RCH=NH + LiX
Механизм второй стадии:
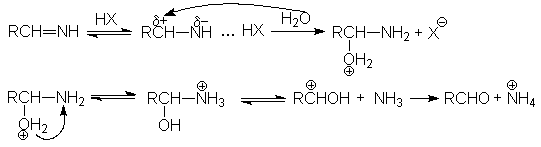
- Взаимодействие
с металлоорганическими соединениями.
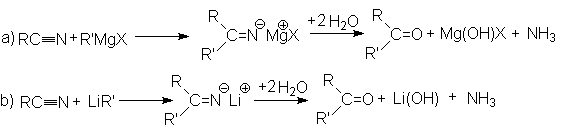
- Реакция
Риттера.
Эта реакция является примером
присоединения атома углерода к гетероатому (азоту).
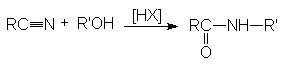
Реакция протекает по карбкатионному механизму:
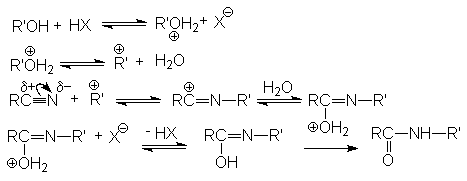
В реакцию вступают только спирты, дающие достаточно стабильные карбкатионы (вторичные, третичные, бензильные и т.п.). Первичные спирты не реагируют. Карбкатионы не обязательно следует генерировать из спирта, его можно получать протонированием алкенов.