Лекция 15.
Поступательная сумма по состояниям и ее вклад в термодинамические
свойства.
Основное уравнение
статистической термодинамики F = Uo – klnz позволяет выразить все
термодинамические функции через величины, характеризующие свойства молекул.
Чтобы рассчитать суммы по состояниям и с их помощью найти различные
термодинамические свойства, необходимо вычислить теоретически или определить на
опыте энергетические уровни системы в целом, в общем виде это пока не возможно.
Уравнения квантовой и классической механики определяют лишь уровни энергии,
отвечающие отдельным составляющим молекулярного движения, а именно: поступательного,
колебательного, вращательного, электронного и ядерного возбуждения. Т.о.,
энергия молекулы идеального газа выражается формулой:
e = eпост. + eкол. + eвр. + eэл. + eяд.
В этой сумме все члены,
кроме первого, отвечают внутримолекулярной энергии и взаимосвязаны. Энергия
поступательного движения не зависит от других видов движения и наоборот,
поэтому полную энергию можно записать: e = eпост. + eвнутр., а соответственно молекулярная сумма
по состояниям: z = zпост × zвнутр.. Для
расчета суммы по состояниям при не слишком высоких температурах прибегают к
упрощениям. В первом приближении считают, что все внутримолекулярные виды
энергии не зависят друг от друга – приближение
Борна-Оппенгеймера, в этом случае для полной суммы по состояниям будем
иметь: : z = zпост × zкол. × zвр. × zэл. × zяд. , т.е. z факторизуется по отдельным видам
движения.
Поступательная
сумма по состояниям (поступательное движение).
Для определения
поступательной суммы по состояниям необходимо использовать уравнение,
описывающее поступательную энергию частиц, в отсутствии потенциальных полей
энергия движения частиц – это кинетическая энергия. В классической механике она
определяется: ![]() .
.
Квазиклассическая сумма
по состояниям для трех степеней свободы поступательное движение одной частицы
выражается через многомерный интеграл: 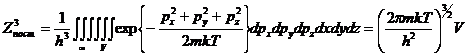 , т.к.
, т.к. ![]() ,
, ![]() , при
, при ![]() .
.
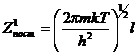 , l – линейный размер системы.
, l – линейный размер системы.
Согласно
квантовой механике для частицы в ящике с ребром l энергия
системы для одной степени свободы вычисляется из уравнения Шредингера:
![]() ,
,
общее решение: ![]() , при х = 0 и х = l ®
, при х = 0 и х = l ® ![]()
при ![]() и B = 0 ®
и B = 0 ® ![]()
![]() , где nx = 1,2… -
квантовое число, определяющее дозволенные значения энергии частицы, движущейся
параллельно оси х.
, где nx = 1,2… -
квантовое число, определяющее дозволенные значения энергии частицы, движущейся
параллельно оси х.
Т.о., одномерные
поступательные движения оказываются квантованными, и это дает квантовую
поступательную сумму по состояниям в виде:
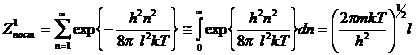 , что полностью
совпадает с выражением для Z1 в квазистатистическом случае.
, что полностью
совпадает с выражением для Z1 в квазистатистическом случае.
Для частицы в потенциальном поле U (x,y,z) полная энергия запишется: ![]() в этом случае поступательная
сумма по состояниям:
в этом случае поступательная
сумма по состояниям: 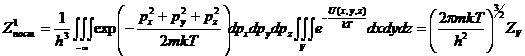 ,
,
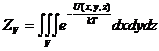 - конфигурационный интеграл.
- конфигурационный интеграл.
Если потенциальная энергия U (x,y,z) – это энергия внешнего поля (напр.,
гравитационного), то вычисление ZV достаточно просто; если же необходимо учесть энергию
межмолекулярных взаимодействий, то нахождение конфигурационного интеграла
становится трудной задачей, т.к. она связана с вычислением кратного интеграла
по координатам множества частиц: 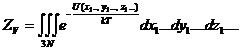
Итак, поступательная сумма по
состояниям для идеального газа в целом будет являться большой суммой по
состояниям:
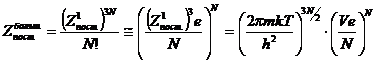
с
помощью данного уравнения вычисляют поступательную составляющую
термодинамических функций для многоатомных идеальных газов.
1.
Средняя энергия поступательного движения: ![]()
2. Давление, через которое выражается
уравнение состояния идеального газа:
![]() , уравнение состояния: pV=NkT
, уравнение состояния: pV=NkT
3. Поступательная составляющая
энергии Гельмгольца:
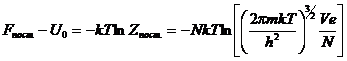
4. Поступательная составляющая энтропии:
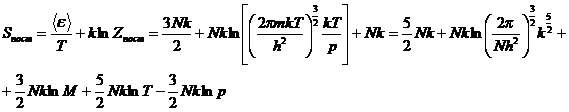
где ![]()
Тогда с учетом всего этого можно
получить уравнение Закура и Тетроде:
Sпост=Rln(M 3/2T 5/2)-RlnP(атм)-2,31 кал/моль∙К
Это уравнение определяет
абсолютную энтропию, т.к. в него входит явно h, что
соответствует использованию квантово-химического подхода и подхода для многих
простых газов (N2, O2). Поступательная энтропия по
абсолютной величине заметно превышает вклад внутренних степеней свободы и
является основной составляющей энтропии газа.
Деление на N! при вычислении поступательной суммы
по состояниям дало более точное значение для энтропии, чем в классической
термодинамике, т.к. в уравнении Закура не появляется
избыток энтропии и энтропия смешения газа с самим собой, которая равна нулю. (Классической выражение: S=S(T)+NkTlnV=nSo(T)+nRlnV)