Лекция 29. Теория активных столкновений.
Оглавление
Одной из первых теорий химических
реакций явилась теория активных столкновений. На рубеже XIX – XX вв. стало очевидно, что столкновения
между реагирующими частицами хотя и являются необходимыми условиями для
протекания химической реакции, но эти условия явились явно недостаточными. Так,
упругие столкновения не приводили к образованию продуктов реакции, а число
двойных столкновений существенно превышало скорости химических реакций: (<< )
![]()
В феноменологической кинетике
появился такой критерий, как энергия активации, а доля активных столкновений
выражалась экспоненциальной зависимостью:
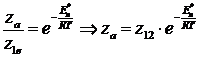
Для ряда реакций было получено
хорошее соотношение между экспериментальными величинами скорости и расчётными
значениями числа активных столкновений:
![]()
Однако такое совпадение чаще не
выполнялось, и Христиансен (1924) ввёл поправочный
множитель Р – стерический
фактор. Предполагалось, что ![]() ,
связано с ориентацией сталкивающихся молекул, т.е. определяется только
геометрическими факторами. В этом случае
,
связано с ориентацией сталкивающихся молекул, т.е. определяется только
геометрическими факторами. В этом случае ![]() .
.
Таким образом, согласно теории соударений – скорость химической реакции равна
числу таких соударений в единице объёма за единицу времени, при
которых соударяющиеся частицы обладают энергией, достаточной для преодоления
барьера и должным образом ориентированных относительно друг друга.
Скорость ![]() можно представить в виде двух
составляющих
можно представить в виде двух
составляющих ![]() и
и ![]() . Очевидно,
. Очевидно,
![]() - тангенциальная составляющая – может
сохранять своё значение, и
- тангенциальная составляющая – может
сохранять своё значение, и ![]() не будет претерпевать существенных
изменений. Что касается
не будет претерпевать существенных
изменений. Что касается ![]() , то, если
, то, если
![]() …
…
Сечение соударений.
При соударении центры частиц
оказываются на расстоянии RA+RB. Сечение соударений:
![]()
Это сечение можно представить как площадь основания
цилиндра, внутри которого движутся центры тех частиц, которые испытывают
соударения с частицей А.
В соответствии с
молекулярно-кинетической теорией газа ![]() может быть найдена
по вязкости газа
может быть найдена
по вязкости газа ![]() :
:
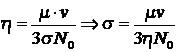
Для газа одного типа, когда rA=rB получим:
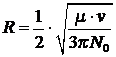
Если ![]() :
:
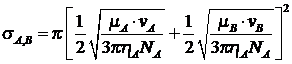
Однако с достаточной точностью ![]() можно оценить исходя из представлений
о плотнейшей упаковке: на молекулу радиусом r при плотной упаковке приходится объём
можно оценить исходя из представлений
о плотнейшей упаковке: на молекулу радиусом r при плотной упаковке приходится объём
![]() , а
моль занимает объём
, а
моль занимает объём ![]() .
Объединяя эти 2 выражения, получаем:
.
Объединяя эти 2 выражения, получаем:
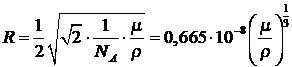
Отсюда, сечение соударений может быть
выражено:
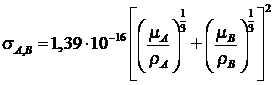
Число активных соударений.
Вывести уравнение для скорости
бимолекулярной реакции – найти такие столкновения, которые удовлетворяли бы
условию
![]()
т.е. число активных столкновений.
В соответствии с максвелловским
распределением вероятность ![]() того, что скорости частиц лежат в
интервале
того, что скорости частиц лежат в
интервале ![]() может быть выражена:
может быть выражена:
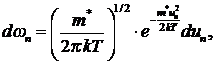
где 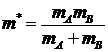 - приведённая масса.
- приведённая масса.
Чтобы частица за время dt ударилась о площадку ![]() ,
она должна оказаться в цилиндре
объёмом
,
она должна оказаться в цилиндре
объёмом ![]() .
.
Отсюда вероятность соударения частицы
с элементом поверхности ![]() с составляющей
с составляющей ![]() :
:
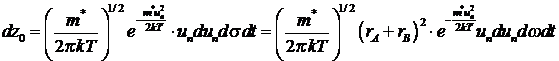
Чтобы найти вероятность (z0)a нужно проинтегрировать это уравнение:
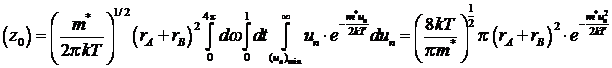
Согласно молекулярно-кинетической
теории газов, средняя относительная скорость движения частиц:
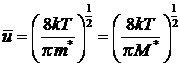
Отсюда:
![]()
Общее число активных столкновений
между частицами А и В:
![]()
Если un=0, то при интегрировании получается
вероятность любого соударения А и В. Эта величина
носит название фактора соударения:
![]()
или
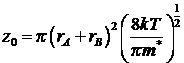
Фактор
соударения
Фактор соударения есть вероятность соударений друг с
другом в течение секунды двух данных частиц, находящихся в объёме 1 см3.
![]() даёт удвоенное соударение, поэтому
полное число соударений двух одинаковых частиц равно:
даёт удвоенное соударение, поэтому
полное число соударений двух одинаковых частиц равно:
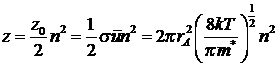
Таким образом, ТАС для бимолекулярных
реакций даёт следующее выражение:
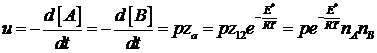
В соответствие с кинетическим
уравнением:
![]()
Подставляя z0 можно получить 2 выражения:
1) для молекул разных видов:
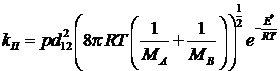
2) 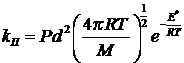
где d – эффективный диаметр столкновений,
который определяется на основе экспериментальных данных (вязкости,
теплопроводности и диффузии).
Эффективный диаметр зависит от температуры. Эта зависимость
может быть найдена по полуэмпирической формуле Сазерленда:
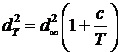
![]() - эффективный диаметр молекул одного
сорта при высокой температуре.
- эффективный диаметр молекул одного
сорта при высокой температуре.
с – постоянная, зависящая от
природы газа.
ТАС Траутцема
и Льюиса позволяет установить количественную связь между Е* и Еа, но не предлагает методов расчёта Е*.
Из выражения ТАС можно получить:

Введя Р, ТАС
не даёт способов его теоретического расчёта.
В ТАС предложена ясная физическая
модель, но из-за схематичности она не в состоянии объяснить влияние инертных добавок
и других факторов на скорость химической реакции. Сама модель взаимодействия
упрощена.