Лекция 36. Неравновесные явления в растворах электролитов.
Частицы раствора
электролита все время совершают хаотические движения, которые осуществляются
периодически перескоками с одного места на другое, но в среднем скомпенсированы,
поэтому ионное равновесие в растворах электролитов имеет динамический характер.
Под действием определенных условий динамическое равновесие может смещаться, вызывая
неравновесные явления в растворах электролитов. Вызвать неравновесные явления
можно следующими способами:
1)
изменением концентрации или активности
растворенного вещества в одной части раствора по отношению к другой без
изменения состава;
2)
наложением электрического поля, вызывающего
направленное перемещение зарядов;
3)
изменением состава раствора по отношению к
равновесной концентрации вещества.
В результате таких
изменений возникают соответствующие потоки. В 1-м случае поток диффузии, во 2-м
– поток миграции, в 3-м – химическая ионная реакция, химический поток.
Величины потоков
обозначаются буквами j: для 1 – jD, 2 – jM, 3 – jX.
Миграция ионов – основа электропроводности электролита и сопровождает работу
всей электрохимической системы.
Общий поток ионов j равен сумме потоков диффузии и миграции:
ji = jD + jM
Химический поток
вещества имеет место не всегда в электрохимической системе, а поток диффузии и миграции
всегда. Поток диффузии прямо пропорционален градиенту концентрации и может быть
записан следующим образом:
jD = -Di grad ci
Di = kDRT(1+dlnfi/dln
ci); fi – коэффициент
активности электролита
Di – коэффициент диффузии.
Поток
миграции
jM = -zi
/| zi | ui
ci grad E
zi – заряд
иона; ui – абсолютная скорость иона
-ui = vi /x
vi –
обычная скорость; x – величина напряженности
электрического поля.
ci – концентрация ионов; E –
электрический потенциал
Общей силой, действующей
на ион в диффузионно-миграционном потоке, является градиент электрохимического
потенциала ![]() .
.
![]()
![]()
zi - заряд иона, F - число
Фарадея
Если
ионы сорта i не перемещаются в растворе, то это
значит, что градиент электрохимического потенциала ![]()
Это равенство
устанавливает связь между абсолютной скоростью движения ионов ui и коэффициентом диффузии Di.
Следовательно, данное
уравнение является расчетным и приводит к следующему:
jD = - jM
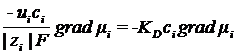
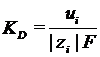 →
→ ![]()
KD –
константа скорости диффузии по аналогии с константой скорости химической реакции
Кхим.р.
jх = kx ci
Коэффициент диффузии
оказывается прямо пропорциональным абсолютной скорости движения ионов. Член в
скобках – поправочный коэффициент, учитывающий ион-ионное взаимодействие.
Для бесконечного
разбавления растворов, когда сi
→ 0, fi
→ 1. А так как ai = сi
fi,
то Di = Di0
Di0
– коэффициент диффузии при нулевой концентрации и является константой, не зависящей
от концентрации.
В этом случае абсолютная
скорость иона будет предельной: ui = ui0,
и коэффициент диффузии иона описывается выражением: Di0
= ui0RT/(|zi|F).
Данное выражение справедливо для 1 моля ионов.
Для одной частицы имеем:
Di0 = ui0kT/(|zi|ē0)
Полученное уравнение
называется уравнением Нернста – Эйнштейна. Оно используется для расчета
коэффициентов диффузии ионов по их подвижностям,
определяемым экспериментально методом электропроводности.