Лекция 41. Закономерности
электрохимической кинетики в условиях замедленной стадии разряда-ионизации.
Оглавление
Основные
уравнения теории замедленного разряда.
Частные
случаи использования уравнений теории замедленного разряда.
Теория, описывающая
кинетические закономерности переноса частиц через границу раздела фаз,
называется теорией замедленного разряда. Пусть скорость электродного процесса
Ох+nē↔Red лимитируется стадией разряда-ионизации. В этих условиях
суммарная скорость процесса, определяемая плотностью тока i: ![]() . При равновесном потенциале Е=Еp i=0:
. При равновесном потенциале Е=Еp i=0: ![]() , i0 – ток
обмена.
, i0 – ток
обмена.
Если Е<0 (Е<Еp),
то ![]() следовательно через
систему потечет катодный ток i>0. При Е>Еp
следовательно через
систему потечет катодный ток i>0. При Е>Еp ![]() в системе потечет
анодный ток i>0.
в системе потечет
анодный ток i>0.
Сдвиг потенциала от
равновесного значения, обусловленный замедленным протеканием стадии
разряда-ионизации называется перенапряжением.
η = Еp –
Е.
Положительному катодному
току соответствует «+» перенапряжение. При лимитирующей стадии
разряда-ионизации нарушается электродное равновесие и уравнение Нернста не
может быть использовано для расчета Е.
Основные уравнения теории замедленного разряда.
Кинетические
уравнения для прямого и обратного электрохимических процессов на основе теории
абсолютных скоростей реакций в первом приближении записаны в виде:![]() ,
, ![]()
К – константа скорости.
ΔG* –
стандартная свободная энергия активации образования активированного комплекса
катодного и анодного процессов.
Сiадс
– концентрация реагентов в адсорбированном состоянии, то есть в плотной части
дв. слоя или на границе между плотным и диффузным слоем.
Если потенциал в месте
нахождения реагирующей частицы обозначить ψ1*
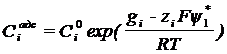
gi –
стандартная свободная энергия специфически адсорбированного компонента i.
ziFψ1* -
электростатическая энергия адсорбции компонента.
Для расчета энергии активации
рассматривается энергетическая диаграмма реакции:
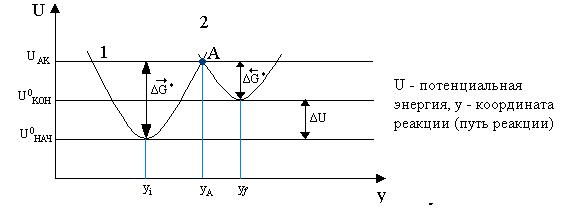
Под путем реакции
понимают те параметры, которые меняются в ходе электродного процесса. При таком
рассмотрении ![]() и
и ![]() есть потенциальная
энергия промежуточного состояния относительно нулевого уровня начального и
конечного состояния соответственно. Любая электрохимическая реакция приводит к
изменению заряда реагирующих частиц и вызывает перераспределение диполей
растворителя. Такая реорганизация растворителя сопровождается значительным
изменением потенциальной энергии, а потому может служить основой для построения
кривых потенциальной энергии, в которых путь реакции или обобщенная координата
y характеризует распределение диполей растворителя. В наиболее простых
электродных процессах Еакт обусловлена реорганизацией диполей
растворителя необходимых для кв. - механического перехода электрона из
начального состояния в конечное (туннельный эффект). Согласно принципу
Франка-Кондона переход электрона без излучения или поглощения квантов энергии
возможно лишь при условии, что полные энергии электрона в начальном и конечном
состоянии происходит под действием тепловых флуктуаций растворителя. Концепция
реорганизации растворителя приводит к установлению механизма элементарного акта
в стадии разряда-ионизации. Такой же механизм имеют и простейшие реакции в
объеме раствора. Характерной особенностью электродных процессов является то,
что в них начальный энергетический уровень электрона можно менять, изменяя
потенциал электрода. Анализ потенциальных кривых для реакции показывает, что
энергетический уровень состояния Ох формы и n электронов в моле зависит от
свободной энергии специфически адсорбированной Ох формы gОх и nF(Е-ψ1*), а а
энергия уравнения Red формы в конечном состоянии зависит только от свободной
энергии gRed. Изменение разницы этих уравнений составляет
δ(ΔU):
есть потенциальная
энергия промежуточного состояния относительно нулевого уровня начального и
конечного состояния соответственно. Любая электрохимическая реакция приводит к
изменению заряда реагирующих частиц и вызывает перераспределение диполей
растворителя. Такая реорганизация растворителя сопровождается значительным
изменением потенциальной энергии, а потому может служить основой для построения
кривых потенциальной энергии, в которых путь реакции или обобщенная координата
y характеризует распределение диполей растворителя. В наиболее простых
электродных процессах Еакт обусловлена реорганизацией диполей
растворителя необходимых для кв. - механического перехода электрона из
начального состояния в конечное (туннельный эффект). Согласно принципу
Франка-Кондона переход электрона без излучения или поглощения квантов энергии
возможно лишь при условии, что полные энергии электрона в начальном и конечном
состоянии происходит под действием тепловых флуктуаций растворителя. Концепция
реорганизации растворителя приводит к установлению механизма элементарного акта
в стадии разряда-ионизации. Такой же механизм имеют и простейшие реакции в
объеме раствора. Характерной особенностью электродных процессов является то,
что в них начальный энергетический уровень электрона можно менять, изменяя
потенциал электрода. Анализ потенциальных кривых для реакции показывает, что
энергетический уровень состояния Ох формы и n электронов в моле зависит от
свободной энергии специфически адсорбированной Ох формы gОх и nF(Е-ψ1*), а а
энергия уравнения Red формы в конечном состоянии зависит только от свободной
энергии gRed. Изменение разницы этих уравнений составляет
δ(ΔU):
δ(ΔU) =
δ[gОх + nF(Е-ψ1*) - gRed]
Из теории реорганизации
растворителя следует, что изменение Е активации прямого процесса составляет
долю α от изменения разницы энергетических уровней.
![]() – соотношение Бренстеда.
– соотношение Бренстеда.
0 ≤ α ≤
1 – коэффициент переноса.
Соотношение было
установлено для объемных химических реакций по переносу протона от кислоты ВН+
к основанию D: ВН+ + D
→ В + DН+.
Теория замедленного
разряда в начальной стадии развития основывалась на закономерностях
восстановления иона гидроксония:
Н3О+
+ ē(Ме) → Ме-Надс + Н2О.
Если в качестве
основания рассматривается металлический электрод, а ион гидроксония как
кислоту, то реакция оказывается аналогичной предыдущей. На этом основании
Фрумкин ввел соотношение Бренстеда в теории замедленного разряда. С учетом
этого:
![]()
![]() - стандартное значение
энергии активации, тогда
- стандартное значение
энергии активации, тогда
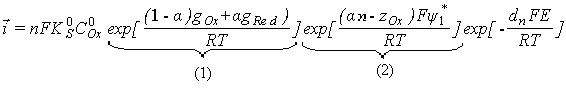
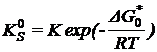 - абсолютная
гетерогенная константа скорости электрохимической реакции. Не зависит от
природы Ме, а зависит от природы реагентов.
- абсолютная
гетерогенная константа скорости электрохимической реакции. Не зависит от
природы Ме, а зависит от природы реагентов.
Множитель (1)
показывает, что скорость стадии разряда тем выше, чем больше энергия
специфической адсорбции реагентов. Этот множитель можно объединить с абсолютной
константой скорости КS0:
![]()
КS
зависит природы Ме.
Множитель (2) отражает
влияние дв. слоя на скорость стадии разряда и его так же объединяют с
константой КS:
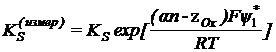 - кажущаяся константа скорости электрохимической
реакции.
- кажущаяся константа скорости электрохимической
реакции.
С учетом данных
соотношений плотности катодного и анодного токов записываются в виде:
![]() ,
, ![]() .
.
КS(измер) одна и
та же, если потенциал Е измерен относительно потенциала Е0 рассмотренной
реакции.
Так как
ток обмена ![]() , то суммарный измер.
ток:
, то суммарный измер.
ток:
![]()
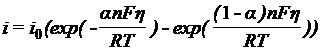 (1)
(1)
η = Еp –
Е – перенапряжение
Так как
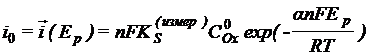 и
и 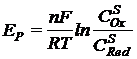 , то
, то ![]() (2)
(2)
(1) и
(2) – основные уравнения теории замедленного разряда.
Частные случаи использования уравнений теории замедленного разряда.
В предположении, что
α и ψ1* не зависят от η можно рассмотреть
частные случаи для измеряемой плотности тока.
1)
при | η |<<RT/nF=25 мВ
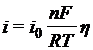 (или η = [RT/nF][i/i0])
(или η = [RT/nF][i/i0])
При малых
перенапряжениях поляризационная характеристика стадии разряда-ионизации
линейна: η = θi, θ = RT/nFi0 –
сопротивление разряда (анолог закона Ома).
2) при η >> RT/nF, i
≈ i0exp(αnFη/RT) или lni
≈ lni0 + αnFη/RT, отсюда η = (-RT/αnF)lni0 + (RT/αnF)lni.
Если (-RT/αnF)lni0 = а, (2,3RT/αnF) = b, то
η = а + blgi –
уравнение Тафеля (уравнение прямой в координатах η от lgi).
По наклону тафелевой
прямой можно найти коэффициент переноса α, а
затем вычислить ток обмена. В случае больших отрицательных перенапряжений
-η >> RT/nF уравнение Тафеля изменится:
η = (-RT/(1-α)nF)lni0 + (RT/(1-α)nF)ln|i|